opis produktu
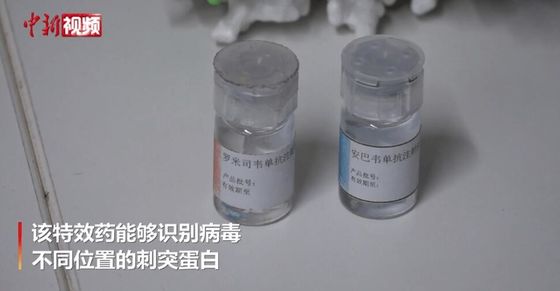
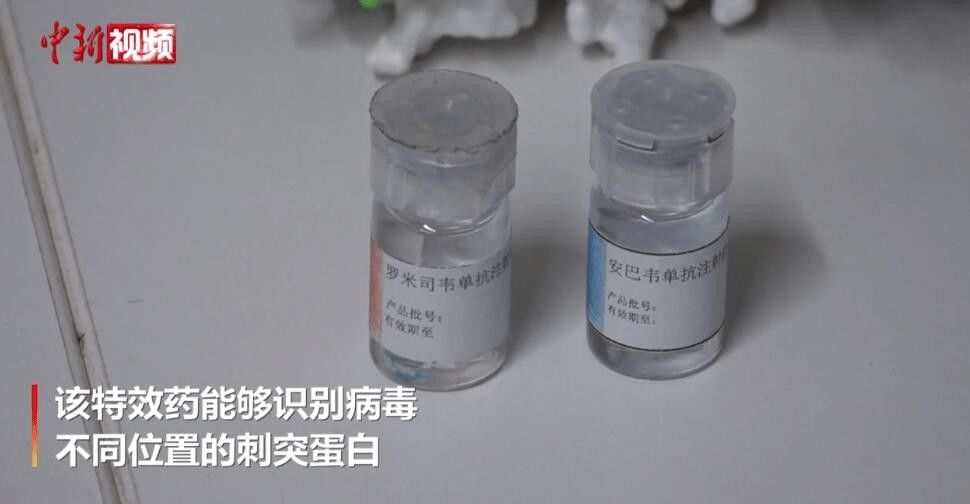
Amubarwimab / Romlusevimab (BRII-196/ BRII-198) Opis przeciwciał monoklonalnych
BRII-196 i BRII-198 nie konkurują z SARS-CoV-2monoklonalne przeciwciała neutralizującepochodzące od wyzdrowiających pacjentów z COVID-19.Przeciwciała monoklonalne zostały specjalnie zaprojektowane w celu zmniejszenia ryzyka wzrostu zależnego od przeciwciał i wydłużenia okresu półtrwania w osoczu w celu uzyskania potencjalnie dłuższego efektu leczenia.Ponadto ich nie nakładające się epitopowe regiony wiążące zapewniają wysoki stopień aktywności neutralizacyjnej przeciwkoSARS-CoV-2beta-koronawirusa.
PołączenieBRII-196/BRII-198WaOprócz współpracy z NIAID, Brii Biosciences prowadzi dodatkowe badania w Chinach.oceniające farmakokinetykę i bezpieczeństwo kombinacji BRII-196/BRII-198 oraz badanie skuteczności fazy 2 kombinacji BRII-196/BRII-198 w leczeniu COVID-19.
Spółka potwierdziła, że wnioski dotyczące badań dotyczących nowego leku zostały złożone do amerykańskiej Agencji ds. Żywności i Leków (FDA) w sprawie terapii skojarzonej.
W sprawieChińska Narodowa Administracja Produktów Medycznych(NMPA) udzieliła zatwierdzenia 9 grudnia 2021 r. dla kombinacji amubarvimab/romlusevimab (wcześniej kombinacja BRII-196/BRII-198)do leczenia u dorosłych i dzieci(w wieku 12-17 lat o masie ciała co najmniej 40 kg) z łagodnym i normalnym typem COVID-19, z wysokim ryzykiem przejścia na ciężką chorobę, w tym hospitalizację lub śmierć.badanie fazy 3final results demonstrated a statistically significant 80% (78% in interim results) reduction of hospitalization and death with fewer deaths through 28 days in the treatment arm (0) relative to placebo (9), oraz lepsze wyniki bezpieczeństwa w porównaniu z placebo u pacjentów z COVID-19, którzy nie zostali hospitalizowani i są narażeni na wysokie ryzyko postępu choroby.Podobne wskaźniki skuteczności obserwowano u uczestników rozpoczynających leczenie wcześnie (0- 5 dni) i późno (6- 10 dni)., po wystąpieniu objawów, dostarczając krytycznie potrzebnych dowodów klinicznych u pacjentów z COVID-19, którzy spóźnili się na leczenie.
Brii Bio(kod akcji:2137. HK) jest międzynarodową firmą z siedzibą w Durham, N.C., Stany Zjednoczone, i PEKIN, Chiny, opracowującą innowacyjne terapie dla chorób o znaczących niezaspokojonych potrzebach medycznych i dużym obciążeniu zdrowia publicznego.Firma Brii Biosciences Limited została włączona jako składnikHang SengWskaźnik złożony. październik 2021 korporacyjnyprezentacja. W dniu 5 grudnia 2021 r. firma Brii Biosciences Limited została dołączona doAkcje HongkonguPołącz się.
Amubarvimab / Romlusevimab (BRII-196/ BRII-198) Historia przeciwciał monoklonalnych
Na początku 2020 r.partnerskieZ Uniwersytetem Tsinghua i Szpitalem Trzeciego Ludu w Shenzhen, aby założyć TSB Therapeutics dla rozwoju BRII-196 i BRII-198.Amubarvimab i Romlusevimab są niekonkurencyjnymi monoklonalnymi przeciwciałami neutralizującymi SARS-CoV-2, pochodzącymi od wyzdrowiających pacjentów z COVID-19..
W mniej niż 20 miesięcy,Brii Bio postępuje.połączenie amubarvimab/romlusevimab od momentu odkrycia do zakończenia fazy 3 rozwoju, co doprowadziło do szybkiego zatwierdzenia przez NMPA.To zatwierdzenie jest bardzo udanym partnerstwem z najlepszymi naukowcami i badaczami klinicznymi w Chinach i na całym świecie w ramach wspólnej misji., w tym 3rd People's Hospital w Shenzhen i Uniwersytecie Tsinghua, którzy odkryli te neutralizujące przeciwciała; US National Institute of Health, AIDS Clinical Trial Group,który sponsorował i prowadził badanie ACTIV-2.
Amubarwimab / Romlusevimab (BRII-196/ BRII-198)
BRII-196/ BRII-198 przeciwciało monoklonalnewskazanew leczeniu pacjentów z COVID-19, którzy nie są hospitalizowani i są narażeni na wysokie ryzyko postępu klinicznego.Pacjentów pediatrycznych(w wieku 12-17 lat o masie ciała co najmniej 40 kg) podlega warunkowemu zatwierdzeniu w Chinach.

 Twoja wiadomość musi mieć od 20 do 3000 znaków!
Twoja wiadomość musi mieć od 20 do 3000 znaków! Proszę sprawdzić email!
Proszę sprawdzić email!  Twoja wiadomość musi mieć od 20 do 3000 znaków!
Twoja wiadomość musi mieć od 20 do 3000 znaków! Proszę sprawdzić email!
Proszę sprawdzić email!